Đó là một nội dung mà Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia đưa ra trong kết luận tại cuộc họp xem xét báo cáo cập nhật, bổ sung kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn 3 vaccine Nanocovax vào ngày 16/12/2021. Các kết quả nghiên cứu cập nhật, bổ sung tính đến ngày 30/11/2021 (báo cáo nộp ngày 09/12/2021).
Được biết, đây là cuộc họp của Hội đồng đạo đức sau khi các đơn vị nghiên cứu vaccine, Nanogen đã gửi cập nhật bổ sung giai đoạn 3 theo công văn số 1652/BYT-K2ĐT ngày 21/11/2021 của Cục khoa học công nghệ và đào tạo, Bộ y tế.
Căn cứ vào biên bản số 100/BB-HĐĐĐ ngày 16/12/2021 của Hội đồng Đạo đức, ngày 20/12/2021, Bộ Y tế đã cho biết một số kết luận cơ bản về vaccine Nanocovax.
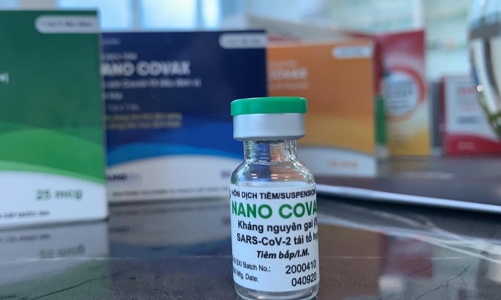
Về tính an toàn, vaccine Nanocovax đạt yêu cầu về tính an toàn tính dựa trên dữ liệu báo cáo bổ sung giữa kỳ phiên bản 8.0 ngày 30/11/2021.
Về tính sinh miễn dịch, đạt yêu cầu về tính sinh miễn dịch theo Hướng dẫn chuyên môn về xem xét tính an toàn và hiệu quả bảo vệ phục vụ đánh giá kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn 3 của vaccine phòng Covid-19 sản xuất trong nước (ban hành kèm theo Quyết định 5259/QĐ-BYT ngày 11/11/2021 của Bộ trưởng Bộ Y tế) dựa trên dữ liệu báo cáo bổ sung giữa kỳ phiên bản 8.0 ngày 30/11/2021.
Về hiệu quả bảo vệ, Hội đồng yêu cầu: "Cần tiếp tục bổ sung dữ liệu các trường hợp mắc Covid-19 theo đề cương nghiên cứu đã được phê duyệt". Chấp nhận đề xuất của tổ chức nhận thử (Học viện Quân Y, Viện Pasteur thành phố Hồ Chí Minh) và nhà tài trợ (Công ty Cổ phần công nghệ sinh học dược Nanogen) về việc xác minh các trường hợp mắc Covid-19 trong nghiên cứu tính đến hết ngày 13/12/2021 làm dữ liệu chính thức để phân tích, đánh giá hiệu lực bảo vệ trực tiếp của vaccine Nanocovax.
Đề nghị tổ chức nhận thử hoàn thiện báo cáo và gửi báo cáo phân tích hiệu lực bảo vệ trực tiếp của vaccine về Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia trước 15h00 ngày 22/12/2021 để xem xét, đánh giá.
Tuy cần phải tiếp tục bổ sung dữ liệu (đã được cấp phép cũng phải bổ sung dữ liệu), nhưng Hội đồng Đạo đức cũng nói rõ: “ Đến nay trong nghiên cứu thử nghiệm lâm sàng vaccine Nanocovax đã có đủ dữ liệu để đánh giá hiệu quả bảo vệ của vaccine nghiên cứu”.
Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia ghi nhận và đánh giá cao sự đóng góp của người tình nguyện tham gia nghiên cứu thử nghiệm lâm sàng vaccine Covid-19 nói chung, vaccine Nanocovax nói riêng.
Và để bảo vệ cho người tình nguyện tham gia nghiên cứu đặc biệt những người tình nguyện được tiêm giả dược, Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia chấp nhận đề xuất của tổ chức nhận thử và nhà tài trợ về việc “mở mù” để tiêm vaccine phòng Covid-19 được Bộ Y tế cấp phép lưu hành cho người tình nguyện tham gia nghiên cứu ở nhóm sử dụng giả dược.
Việc “mở mù” là cần thiết vì để đảm bảo tính công bằng khách quan trong nghiên cứu khoa học, nên một số tình nguyện viên chỉ được tiêm giả dược nhưng họ và cả người thực hiện tiêm cũng không được biết (làm mù), nay “mở mù” để làm rõ ai tiêm giả dược thì cần được tiêm vaccine phòng Covid-19 được Bộ Y tế cấp phép lưu hành.
Như vậy, với kết luận đó của Hội đồng Đạo đức một lần nữa cho thấy vaccine Nanocovax đầu tiên của Việt Nam là ứng viên sáng giá, đủ điều kiện để Hội đồng Tư vấn cấp phép thuốc và nguyên liệu làm thuốc xem xét, tư vấn cho Bộ Y tế cấp phép có điều kiện theo Thông tư 11 của Bộ Y tế.














![[Interactive]: Toàn cảnh kinh tế Việt Nam quý 4/2025](https://premedia.vneconomy.vn/files/uploads/2026/01/06/3e4055b2e2264c47bacde654709d0e80-61735.png?w=1050&h=630&mode=crop)



![[Phóng sự ảnh]: Người dân xếp hàng sớm mua vàng ngày vía Thần tài](https://premedia.vneconomy.vn/files/uploads/2026/02/25/68ed589db1ff4f769c7df0a9d775f435-71854.jpg?w=600&h=337&mode=crop)
